OBJECTIVE.
神戸大学理学研究科の松原亮介准教授、分子フォトサイエンス研究センターの小堀康博教授、立教大学理学部の山中正浩教授の共同研究チームは、希少金属 注1)を使用せずにCO2からギ酸 注2)を製造する方法を開発しました。
地球温暖化ガスの一つであるCO2の大気中濃度の増加が社会問題化しています。さらに、人類活動に欠かせない化石燃料(石油や天然ガスなど)の枯渇は、近い将来必ず訪れるといわれています。この二つの課題を同時に解決する一石二鳥の手法として、太陽光を用いてCO2を化石燃料またはそれに準ずるものに化学変換する方法、いわゆる人工光合成が有望視されており、現在世界中でその研究が進められています。しかしながら、報告されるほとんどの方法では希少金属の使用が必須であり、地球規模の大きなスケールで行うには大きなハードルが残されていました。
今回松原准教授らは、希少金属を含まない触媒系注3)を新たに創製し、室温、一気圧のCO2雰囲気という穏和な条件で、CO2をギ酸に変換できる光化学反応を開発しました。この反応では外部からのエネルギーとして電気エネルギーを注入する必要はなく、太陽光のみで反応が進行します。
今後は、今回の反応では必須であった犠牲還元剤注4)を用いなくてもよい触媒系や、メタンやメタノールなどギ酸以外の炭素燃料を製造する反応の開発を行っていく予定です。
本研究成果は令和5年3月23日(木)16時(英国時間。日本時間:3月24日(金)午前1時)に英国Nature Publishing GroupのNature Chemistryのオンライン速報版で公開されます。
今回松原准教授らは、希少金属を含まない触媒系注3)を新たに創製し、室温、一気圧のCO2雰囲気という穏和な条件で、CO2をギ酸に変換できる光化学反応を開発しました。この反応では外部からのエネルギーとして電気エネルギーを注入する必要はなく、太陽光のみで反応が進行します。
今後は、今回の反応では必須であった犠牲還元剤注4)を用いなくてもよい触媒系や、メタンやメタノールなどギ酸以外の炭素燃料を製造する反応の開発を行っていく予定です。
本研究成果は令和5年3月23日(木)16時(英国時間。日本時間:3月24日(金)午前1時)に英国Nature Publishing GroupのNature Chemistryのオンライン速報版で公開されます。
ポイント
- 希少な金属を用いずにCO2をギ酸に変換する光化学反応を開発
- 地球温暖化ガスの減少と化石燃料の製造を同時に達成する一石二鳥反応の実用化に期待
研究の背景と経緯
植物の光合成を担う酵素は、太陽光を用いてCO2を糖(グルコース)に変換するという、反応開発の科学者から見ると神がかった機能を持つ触媒といえます。光合成により長年地球の大気環境は一定に保たれてきたのですが、人類文明の急速な発展により、植物が持つ恒常化効果を人類活動(CO2排出と化石燃料の消費)が上回るようになりました。そのため、人工光合成の開発が人類の存続には不可欠な状況となり、世界中で研究が行われています。その研究の中で、金属元素、特に地殻にわずかしか存在しない希少金属が高い触媒活性を持つことがわかってきました。しかし、希少であるが故に地球規模の大きなスケールへ実用展開することが難しいという問題があります。
これまで松原准教授らは、高い還元力(電子を他の分子に与える力)を有する非金属光増感剤注5)の研究を行ってきました。最近では、分子構造を修飾することにより、紫外光よりもエネルギーの低い可視光を照射することでも高い還元力を獲得できる非金属光増感剤を開発しています。これにより、可視光成分を主成分とする太陽光をそのまま利用できる光反応が実現可能となりました。
本研究では、これまでの光増感剤に加えてさらに別の非金属触媒を併用することで、可視光照射下でのCO2光還元を達成しました。
これまで松原准教授らは、高い還元力(電子を他の分子に与える力)を有する非金属光増感剤注5)の研究を行ってきました。最近では、分子構造を修飾することにより、紫外光よりもエネルギーの低い可視光を照射することでも高い還元力を獲得できる非金属光増感剤を開発しています。これにより、可視光成分を主成分とする太陽光をそのまま利用できる光反応が実現可能となりました。
本研究では、これまでの光増感剤に加えてさらに別の非金属触媒を併用することで、可視光照射下でのCO2光還元を達成しました。
研究の内容
触媒系の構築:CO2をギ酸にするためには、CO2に電子を与える、すなわち還元する必要があります。しかしCO2は非常に安定な分子であり、還元するのは容易ではありません。今回我々は、カルバゾール1を光増感剤として新たに創製し、この分子が可視光照射下で極めて高い還元力を獲得することを明らかにしました(図1)。この光増感剤だけではCO2光還元反応(ギ酸生成反応)の効率は低くとどまりましたが、ここに非金属触媒2を添加するとギ酸の生成速度が劇的に向上することを発見しました。最適化された条件においては、一分子のカルバゾール1からギ酸を6500分子以上も生成できることが分かり、優れた触媒系が構築できたと言えます。
反応機構の解明:開発したCO2光還元反応の機構解明の研究を行いました。
(1)13C注6)でラベル化されたCO2を用いて反応を行ったところ、13Cでラベル化されたギ酸が生成しました。このことにより、たしかにギ酸がCO2から生成していることを証明できました。
(2)カルバゾール1が光を吸収した後、どのような過程で電子の移動が起こるのかを時間分解分光法注7)を用いて調べました(図2a)。その結果、カルバゾール1は光を吸収後、ナノ秒からマイクロ秒(ナノ秒は10億分の1秒、マイクロ秒は100万分の1秒)の時間スケールで、触媒2の前駆体3(図1)とCO2のそれぞれに電子を受け渡していることを明らかにしました。
(3)CO2がカルバゾール1から電子を受け取った後、CO2ラジカルアニオンという化学種に変換されます。CO2ラジカルアニオンがその後ギ酸へと変換される過程をコンピュータ計算により解析しました(図2b)。その結果、CO2ラジカルアニオンと触媒2が水素原子のやり取りを行ってギ酸を生成していることが明らかになりました。
上記の検討から、本反応の反応機構を提唱しました。
反応機構の解明:開発したCO2光還元反応の機構解明の研究を行いました。
(1)13C注6)でラベル化されたCO2を用いて反応を行ったところ、13Cでラベル化されたギ酸が生成しました。このことにより、たしかにギ酸がCO2から生成していることを証明できました。
(2)カルバゾール1が光を吸収した後、どのような過程で電子の移動が起こるのかを時間分解分光法注7)を用いて調べました(図2a)。その結果、カルバゾール1は光を吸収後、ナノ秒からマイクロ秒(ナノ秒は10億分の1秒、マイクロ秒は100万分の1秒)の時間スケールで、触媒2の前駆体3(図1)とCO2のそれぞれに電子を受け渡していることを明らかにしました。
(3)CO2がカルバゾール1から電子を受け取った後、CO2ラジカルアニオンという化学種に変換されます。CO2ラジカルアニオンがその後ギ酸へと変換される過程をコンピュータ計算により解析しました(図2b)。その結果、CO2ラジカルアニオンと触媒2が水素原子のやり取りを行ってギ酸を生成していることが明らかになりました。
上記の検討から、本反応の反応機構を提唱しました。
今後の展開
今回開発した反応では、犠牲還元剤としてビタミンC(アスコルビン酸)が必要であり、改善するべき点と言えます。今後はアスコルビン酸ではなく水を還元剤とする反応の開発を進める予定です。さらに、ギ酸以外のエネルギー材料としてメタンやメタノールを製造するCO2光還元反応の開発も目指します。
参考資料
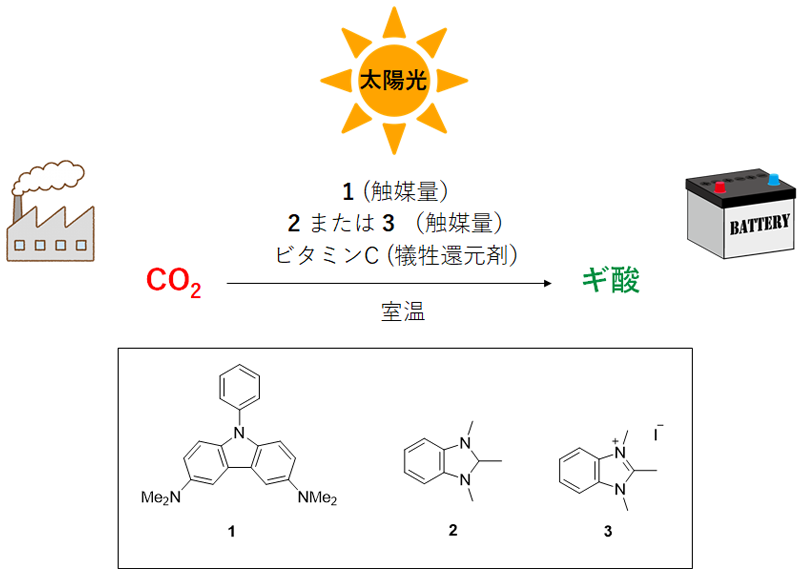
図1.希少金属を使用しないCO2光還元反応によるギ酸製造
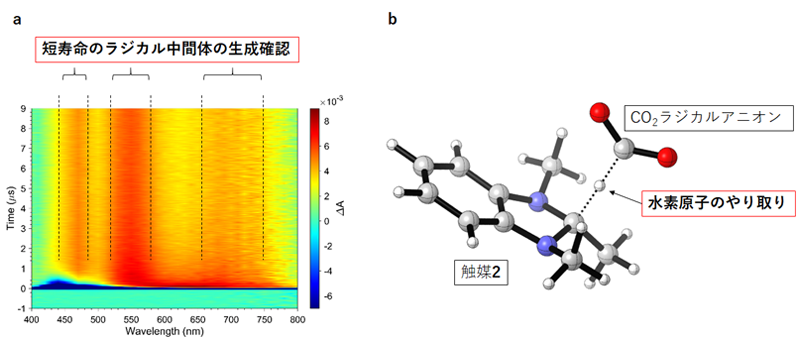
図2.反応機構の解析実験
(a)時間分解分光法による短寿命化学種の検出。特殊な分析装置を用いて、100万分の1秒オーダーでの反応追跡を行った結果、予測していた短寿命中間体由来のシグナルが確認された。(b)計算化学による反応途中の分子構造解析。観測が困難な反応途中の様子をコンピュータによる計算で解析し、予測していた反応形式が妥当であることを確認した。
用語解説
注1)希少金属:地球上で実質的に採掘可能な量が少ない金属元素。種々の反応において高い触媒活性を示すことが多いが、高価格、かつ社会情勢で供給が不安定になりやすい点がしばしば問題となる。
注2)ギ酸:HCOOHの分子式を有するカルボン酸。近年、水素やメタノールなどと並んで燃料電池の材料として注目されているエネルギー資源の一つ。
注3)触媒系:反応前後で自分自身の形を変化させずに反応を加速する物質を触媒という。自分自身の形が変わらないので、自分の重さよりもはるかに多い量の目的物を製造することも可能であり、現在の化学工業の要となっている。触媒に加えて添加剤や溶媒、反応温度など、触媒反応の条件全体を指して触媒系と呼ぶ。
注4)犠牲還元剤:還元反応において電子の源として機能する物質を還元剤と呼ぶ。水素の製造やCO2の還元などのエネルギー製造プロセスにおいて、もっとも理想的な還元剤は水である。しかし、水の直接的な利用が難しい場合には代わりになる還元剤を用いる。その時の還元剤を特に犠牲還元剤と呼ぶ。
注5)光増感剤:光を吸収して、得た光エネルギーを化学反応に利用できる分子。光触媒とほぼ同じ意味で使われる場合もある。
注6)13C:炭素原子の安定同位体の一つ。天然に存在する炭素原子の99%は陽子6個と中性子6個を原子核に持つ12Cであり、中性子を1個多く持つ13Cはわずかに1%しかない。そのため、ある物質の炭素原子がどの炭素原子由来なのかを調べる際、人工的に13Cの割合を天然存在比よりも高めた(13Cでラベル化されていると言う)分子を用いて反応を行い、13Cの行き先を調べる実験方法がよく用いられる。
注7)時間分解分光:光吸収や発光を波長ごとに分割して観測し、物質の性質や量を調べる分析法を分光と呼ぶ。分光を、ある時点(例えば光照射時点)からの経過時間ごとに連続的に行う分析のことを時間分解分光と呼ぶ。10億分の1秒など極めて短い時間単位での解析も可能。
注2)ギ酸:HCOOHの分子式を有するカルボン酸。近年、水素やメタノールなどと並んで燃料電池の材料として注目されているエネルギー資源の一つ。
注3)触媒系:反応前後で自分自身の形を変化させずに反応を加速する物質を触媒という。自分自身の形が変わらないので、自分の重さよりもはるかに多い量の目的物を製造することも可能であり、現在の化学工業の要となっている。触媒に加えて添加剤や溶媒、反応温度など、触媒反応の条件全体を指して触媒系と呼ぶ。
注4)犠牲還元剤:還元反応において電子の源として機能する物質を還元剤と呼ぶ。水素の製造やCO2の還元などのエネルギー製造プロセスにおいて、もっとも理想的な還元剤は水である。しかし、水の直接的な利用が難しい場合には代わりになる還元剤を用いる。その時の還元剤を特に犠牲還元剤と呼ぶ。
注5)光増感剤:光を吸収して、得た光エネルギーを化学反応に利用できる分子。光触媒とほぼ同じ意味で使われる場合もある。
注6)13C:炭素原子の安定同位体の一つ。天然に存在する炭素原子の99%は陽子6個と中性子6個を原子核に持つ12Cであり、中性子を1個多く持つ13Cはわずかに1%しかない。そのため、ある物質の炭素原子がどの炭素原子由来なのかを調べる際、人工的に13Cの割合を天然存在比よりも高めた(13Cでラベル化されていると言う)分子を用いて反応を行い、13Cの行き先を調べる実験方法がよく用いられる。
注7)時間分解分光:光吸収や発光を波長ごとに分割して観測し、物質の性質や量を調べる分析法を分光と呼ぶ。分光を、ある時点(例えば光照射時点)からの経過時間ごとに連続的に行う分析のことを時間分解分光と呼ぶ。10億分の1秒など極めて短い時間単位での解析も可能。
謝辞
本成果は、次の助成の支援のもと行われました。
(松原)ENEOS東燃ゼネラル研究奨励・奨学会、高橋産業経済研究財団、鷹野学術振興財団、福岡直彦記念財団、金森財団
(小堀)JSPS科学研究費(“動的エキシトン”学術変革領域研究(A) JP20H05832, JP20K21174, JP20KK0120, JP22K19008)
(松原)ENEOS東燃ゼネラル研究奨励・奨学会、高橋産業経済研究財団、鷹野学術振興財団、福岡直彦記念財団、金森財団
(小堀)JSPS科学研究費(“動的エキシトン”学術変革領域研究(A) JP20H05832, JP20K21174, JP20KK0120, JP22K19008)
論文情報
- タイトル
“Metal-free reduction of CO2 to formate using a photochemical organohydride-catalyst recycling strategy”(有機ヒドリドの再生反応を基盤とした非金属触媒的CO2光還元によるギ酸合成)
DOI:10.1038/s41557-023-01157-6
- 著者
Weibin Xie, Jiasheng Xu, Ubaidah Md Idros, Jouji Katsuhira, Masaaki Fuki, Masahiko Hayashi, Masahiro Yamanaka, Yasuhiro Kobori, Ryosuke Matsubara
- 掲載誌
Nature Chemistry
その他についての最新記事
-
2026/02/16 (MON)