OBJECTIVE.
立教大学(東京都豊島区、総長:西原廉太)理学部の岡敏彦教授は、若年性パーキンソン病の原因遺伝子変異の新たなメカニズムの解明に成功しました。本研究の成果は、米国学術誌「Cell Reports」において5月9日午前0:00(日本時間、米国東部時間で5月8日午前11:00)付けで発表されます。
1)研究成果の概要
近年、注目が高まっているミトコンドリアは、細胞内部にある小器官(膜で囲まれた区画)で、私たちの体で使われるエネルギーの主要な産生の場です。ミトコンドリアでは、エネルギー産生に伴って生じた活性酸素種※1によりダメージを受けることがあります。エネルギーを大量に作ったミトコンドリアにはダメージが蓄積し、その機能が低下してゆきます。細胞は、このような障害を受けたミトコンドリアを積極的に分解・排斥することで、効率的なエネルギーの産生を維持しています(「ミトコンドリア品質管理※2」と呼ばれる機構)。
若年性パーキンソン病原因遺伝子産物PINK1は、障害を受けたミトコンドリア上で活性化し、その排斥を促すミトコンドリア・センサーとして働くタンパク質です。パーキンソン病の患者では、障害ミトコンドリアが上手く排除できないことが発症の1つの原因だと考えられています。これまでパーキンソン病患者で見つかったPINK1変異のうち、PINK1の酵素活性に直接的に関わるものは一部であり、他の変異がどのようにPINK1機能に干渉するのかは不明でした。このたび、立教大学理学部の岡敏彦教授のグループは、京都産業大学生命科学部の遠藤斗志也教授のグループや徳島大学藤井節郎記念医科学センターの小迫英尊教授のグループなどと共に、障害ミトコンドア上でのPINK1の新たな活性化メカニズムと、それを阻害するPINK1変異を発見しました。
立教大学および京都産業大学の赤羽しおり研究員らは、PINK1がミトコンドリア内膜透過装置のTIM23タンパク質とタンパク質複合体を形成することを発見しました。そして、TIM23は障害ミトコンドリアでPINK1をタンパク質分解酵素から保護することで、障害ミトコンドリアの排斥を促すことを突き止めました。さらに、或るPINK1変異はPINK1とTIM23との相互作用を弱めることで、PINK1の活性化を阻害することが明らかになりました。今回の研究成果は、障害ミトコンドリアの排斥機構のさらなる理解に貢献するだけでなく、若年性パーキンソン病の病態の理解と治療への一助となることが期待されます。
本研究の成果が米国学術誌「Cell Reports」に5月9日付(日本時間)にて発表されますので、ここにお知らせ致します。
若年性パーキンソン病原因遺伝子産物PINK1は、障害を受けたミトコンドリア上で活性化し、その排斥を促すミトコンドリア・センサーとして働くタンパク質です。パーキンソン病の患者では、障害ミトコンドリアが上手く排除できないことが発症の1つの原因だと考えられています。これまでパーキンソン病患者で見つかったPINK1変異のうち、PINK1の酵素活性に直接的に関わるものは一部であり、他の変異がどのようにPINK1機能に干渉するのかは不明でした。このたび、立教大学理学部の岡敏彦教授のグループは、京都産業大学生命科学部の遠藤斗志也教授のグループや徳島大学藤井節郎記念医科学センターの小迫英尊教授のグループなどと共に、障害ミトコンドア上でのPINK1の新たな活性化メカニズムと、それを阻害するPINK1変異を発見しました。
立教大学および京都産業大学の赤羽しおり研究員らは、PINK1がミトコンドリア内膜透過装置のTIM23タンパク質とタンパク質複合体を形成することを発見しました。そして、TIM23は障害ミトコンドリアでPINK1をタンパク質分解酵素から保護することで、障害ミトコンドリアの排斥を促すことを突き止めました。さらに、或るPINK1変異はPINK1とTIM23との相互作用を弱めることで、PINK1の活性化を阻害することが明らかになりました。今回の研究成果は、障害ミトコンドリアの排斥機構のさらなる理解に貢献するだけでなく、若年性パーキンソン病の病態の理解と治療への一助となることが期待されます。
本研究の成果が米国学術誌「Cell Reports」に5月9日付(日本時間)にて発表されますので、ここにお知らせ致します。
2)研究の背景
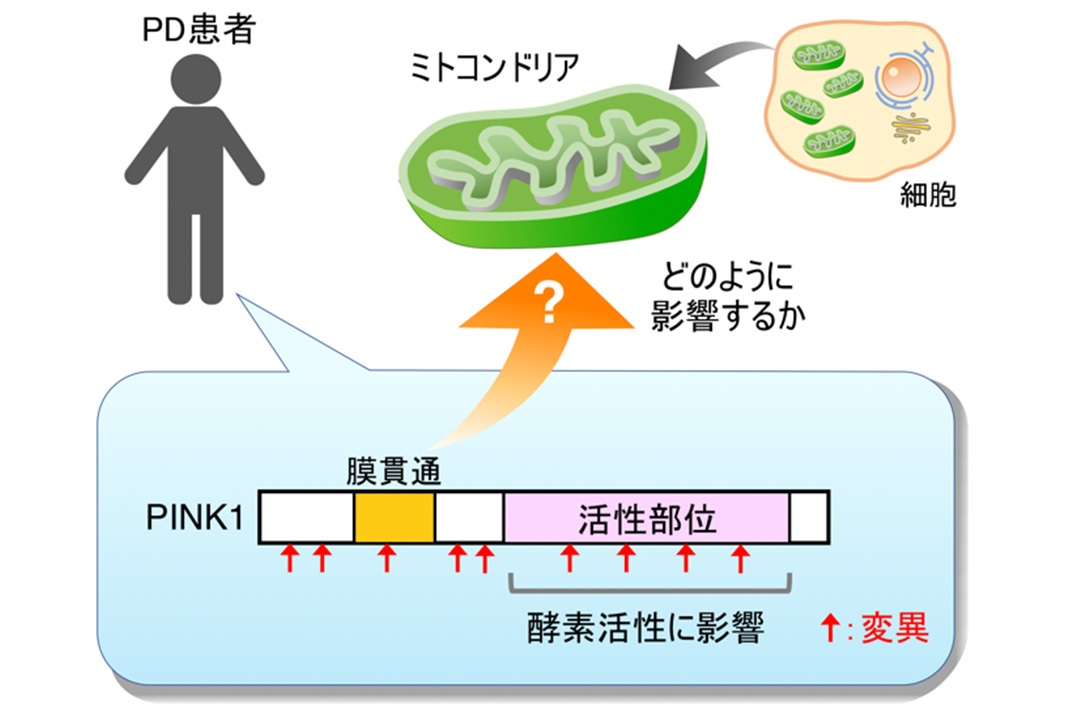
図1.パーキンソン病(PD)患者に見つかるPINK1変異
ミトコンドリア・センサーとして働くPINK1タンパク質は、細胞質で合成された後にミトコンドリアへと輸送されます。障害を受けていない正常なミトコンドリアでは、速やかに分解されるためPINK1は蓄積しません。しかし、障害を受けたミトコンドリアでは、PINK1は分解されずミトコンドリア上に蓄積し、タンパク質複合体を形成します。これにより、PINK1の酵素活性が上昇し、別の若年性パーキンソン病の原因遺伝子産物であるParkinを障害ミトコンドリアへと呼び込みます。Parkinはミトコンドリア分解の標識となるタンパク質を障害ミトコンドリアに付加することで、積極的なミトコンドリアの排斥を促します。つまり、PINK1活性化のための蓄積とタンパク質複合体形成が、障害ミトコンドリア排斥の最初の重要なステップとなっています。しかし、これまでPINK1がどのようなタンパク質と複合体を形成するのかは詳しくは分かっていませんでした。また、パーキンソン病患者で見つかったPINK1変異のうち、酵素活性に影響を与えるもの以外では、PINK1の蓄積と複合体形成を阻害するものは知られていませんでした(図1)。
3)研究内容と成果
赤羽しおり研究員らは、徳島大学藤井節郎記念医科学センターとの共同研究により、障害ミトコンドリア上でPINK1と相互作用するタンパク質を網羅的に解析し、TIM23を見出しました。TIM23は、ミトコンドリアへ輸送されるタンパク質がミトコンドリア内膜を通過するための孔となる膜透過装置を構成するタンパク質の1つです。ミトコンドリア内へのタンパク質の輸送は障害ミトコンドリアでは起こらないため、これまでTIM23機能の解析は専ら正常なミトコンドリアのみで行われてきました。そこで、障害ミトコンドリアでTIM23量を減少させたところ、PINK1の蓄積が強く阻害され、その後のParkinのミトコンドリアへの標的も抑制されました。この結果は、TIM23が正常なミトコンドリアでタンパク質膜透過装置※3として働くだけでなく、障害ミトコンドリアではPINK1の活性化を促進する2つの機能を持つことを示しています。
次に、TIM23が無いために起こるPINK1の減少が、どのタンパク質分解酵素に因るかを調べたところ、ミトコンドリア内膜に存在するOMA1の発現を抑制することで、PINK1量の回復が確認できました。OMA1は障害ミトコンドリアで活性化する分解酵素で、ミトコンドリア形態やストレス応答を制御することが知られています。つまり、障害ミトコンドリアで活性化したOMA1はPINK1も基質とするため、TIM23が無い状態ではOMA1によるPINK1分解が起きることが推察されます。以上の結果より、TIM23はOMA1分解から保護することで、障害ミトコンドリアでのPINK1の活性化を促していると考えられます。このTIM23によるPINK1保護メカニズムは、ミトコンドリア膜透過装置の新規機能というだけでなく、PINK1の新たな活性化機構を提示しています。
次に、TIM23が無いために起こるPINK1の減少が、どのタンパク質分解酵素に因るかを調べたところ、ミトコンドリア内膜に存在するOMA1の発現を抑制することで、PINK1量の回復が確認できました。OMA1は障害ミトコンドリアで活性化する分解酵素で、ミトコンドリア形態やストレス応答を制御することが知られています。つまり、障害ミトコンドリアで活性化したOMA1はPINK1も基質とするため、TIM23が無い状態ではOMA1によるPINK1分解が起きることが推察されます。以上の結果より、TIM23はOMA1分解から保護することで、障害ミトコンドリアでのPINK1の活性化を促していると考えられます。このTIM23によるPINK1保護メカニズムは、ミトコンドリア膜透過装置の新規機能というだけでなく、PINK1の新たな活性化機構を提示しています。
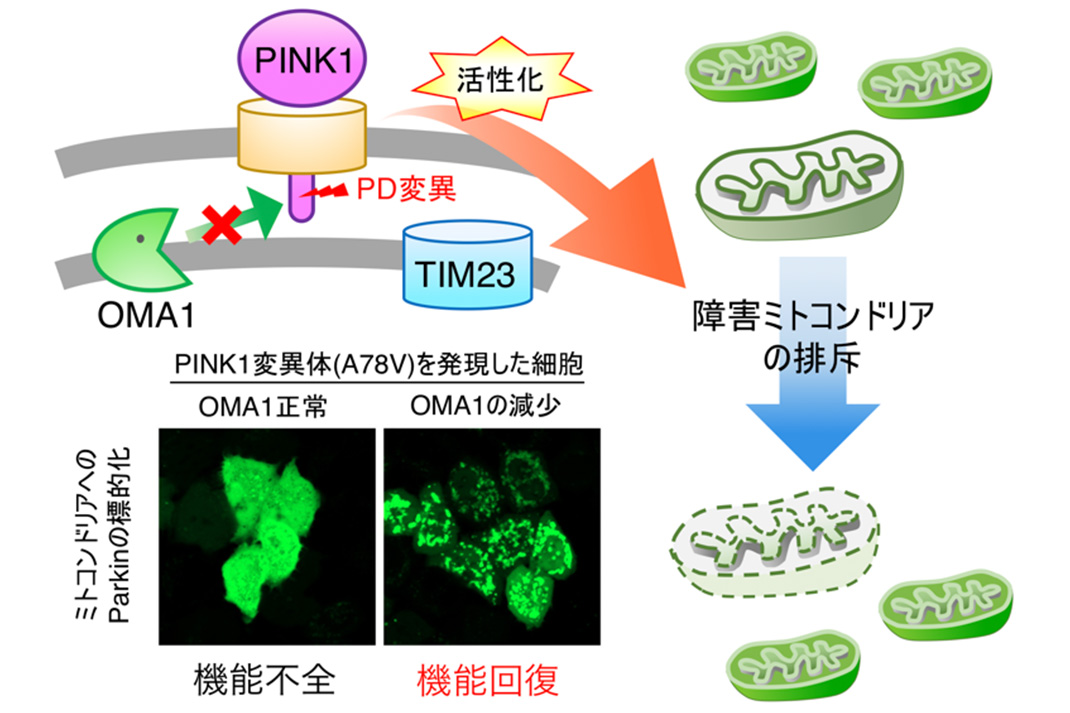
図2.OMA1阻害はPINK1変異を抑圧し障害ミトコンドリアの排斥を促す
パーキンソン病患者で見つかるPINK1変異が、今回明らかになったTIM23によるPINK1保護メカニズムに影響を与えるかを、24種のPINK1変異体を用いて調べたところ、3つのPINK1変異がPINK1とTIM23との相互作用を弱めることが確認できました。さらに、これらのPINK1変異体は通常では活性化し難いのですが、OMA1を減少させることで効率良くParkinをミトコンドリアへ標的化させることができました。この結果は、OMA1の減少がPINK1変異体の蓄積・活性化を引き起こすことで、障害ミトコンドリアの排斥を促進することを示唆しており、PINK1変異による障害を回復できる可能性を提示しています(図2)。
4)今後への期待
本研究の成果により、或るPINK1変異ではPINK1とTIM23との相互作用が弱まった結果、ミトコンドリア・センサーであるPINK1が減少し、障害ミトコンドリアの排斥が滞り、パーキンソン病の発症へと繋がる新たな分子メカニズムが提唱されました。今後は、OMA1の活性阻害やPINK1とTIM23との相互作用の強化をターゲットとした創薬により、新たな治療戦略が展開されることが期待できます。
用語解説
※1.活性酸素種(Reactive Oxygen Species:ROS):
過酸化水素を代表とする反応性の高い酸素分子を含む化合物。ミトコンドリアの呼吸の過程で、一部の酸素分子より生じる。
※2.ミトコンドリア品質管理:
障害を受けて機能が低下したミトコンドリアを選択的に分解・排斥することで、活発なミトコンドリアの比率を高め、全体としての品質を維持・管理する機構。
※3.タンパク質膜透過装置:
細胞小器官の生体膜を通過してタンパク質を内部に輸送する際に使う孔を構成するタンパク質複合体。細胞小器官を構成する多くのタンパク質は細胞質で構成された後に、目的の細胞小器官の生体膜を超えて内部に運ばれる。
過酸化水素を代表とする反応性の高い酸素分子を含む化合物。ミトコンドリアの呼吸の過程で、一部の酸素分子より生じる。
※2.ミトコンドリア品質管理:
障害を受けて機能が低下したミトコンドリアを選択的に分解・排斥することで、活発なミトコンドリアの比率を高め、全体としての品質を維持・管理する機構。
※3.タンパク質膜透過装置:
細胞小器官の生体膜を通過してタンパク質を内部に輸送する際に使う孔を構成するタンパク質複合体。細胞小器官を構成する多くのタンパク質は細胞質で構成された後に、目的の細胞小器官の生体膜を超えて内部に運ばれる。
論文情報
- タイトル:TIM23 facilitates PINK1 activation by safeguarding against OMA1-mediated degradation in damaged mitochondria
- 著者:Shiori Akabane, Kiyona Watanabe, Hidetaka Kosako, Shun-ichi Yamashita, Kohei Nishino, Masahiro Kato, Shiori Sekine, Tomotake Kanki, Noriyuki Matsuda, Toshiya Endo and Toshihiko Oka
- 誌名:Cell Reports
- URL:https://www.cell.com/cell-reports/home
研究活動についての最新記事
-
2026/03/09 (MON)