OBJECTIVE.
JST戦略的創造研究推進事業において、立教大学 理学部の向井 崇人 助教、末次 正幸 教授らの研究グループは、大腸菌ゲノムの分割と移植(インストール)技術を開発しました。
大腸菌ゲノムは460万塩基対の1つの環状DNAからなり、大腸菌から取り出して操作したり、別の大腸菌に移植したりするには大き過ぎるという問題がありました。本研究では、大腸菌ゲノムを3分割して小さくすることに成功し(分割ゲノム1つ当たりのサイズは100万塩基対)、さらに分割ゲノムを大腸菌から取り出し、別の大腸菌にインストールする技術を開発しました。この成果は、ゲノムの複製・分配のメカニズム解明につながるだけでなく、生命の設計図であるゲノムを入れ換え、機能デザインされた生命を創り出す合成生物学のツールとしての利用が期待されます。
本研究成果は、2021年4月28日(英国時間)に英国科学誌「Nucleic Acids Research」のブレイクスルー・ペーパーとしてオンライン版で公開されました。
ポイント
- 大腸菌ゲノムを3つの100万塩基対からなる環状DNAに分割した状態で保持させることに成功した。
- 分割ゲノムを大腸菌から取り出して、別の大腸菌に移植する技術を開発した。
- 人工合成した分割ゲノムを移植し、有用な機能がデザインされた人工大腸菌を構築するといった、合成生物学での展開が期待される。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
本研究では、試験管内再構成技術および微細加工・操作技術を用いて「セルフリーOn chipゲノム合成技術」を開発、合成ゲノムを細胞に移植して起動させるところまでを評価し、「作って起動し評価する」サイクルを高速かつ低コストで回すことを目指します。最終的に、開発したゲノム合成技術を使って、大腸菌ゲノムのミニマム化と、デフラグ化を進め、ゲノムを完全理解可能なレベルにまで単純化した「ミニマムプラットフォームセル」を構築します。
戦略的創造研究推進事業 チーム型研究(CREST)
- 研究領域:「ゲノムスケールのDNA設計・合成による細胞制御技術の創出」(研究総括:塩見 春彦 慶應義塾大学 医学部 教授)
- 研究課題名:「人工ゲノムのセルフリーOn chip合成とその起動」
- 研究代表者:末次 正幸(立教大学 理学部 教授)
- 研究期間:平成30年10月~令和5年3月
本研究では、試験管内再構成技術および微細加工・操作技術を用いて「セルフリーOn chipゲノム合成技術」を開発、合成ゲノムを細胞に移植して起動させるところまでを評価し、「作って起動し評価する」サイクルを高速かつ低コストで回すことを目指します。最終的に、開発したゲノム合成技術を使って、大腸菌ゲノムのミニマム化と、デフラグ化を進め、ゲノムを完全理解可能なレベルにまで単純化した「ミニマムプラットフォームセル」を構築します。
研究の背景と経緯
生命の設計図であるゲノムは、4文字のDNA配列によってコードされたオペレーションシステム(OS)と見なすことができます。OSを起動するためのハードウェアが膜に包まれた細胞です。近年の合成生物学の進展は、OSを書き換え、細胞機能を人為的にデザインすることを可能としてきました。その最たる例は、2010年のクレイグベンター研究所による研究です。マイコプラズマという小さなバクテリアのゲノム、全長(100万塩基対)を人工合成し、そのゲノムを細胞にインストールすることで、新たな細胞を生み出したと報告しています。
しかし、いまだゲノムのインストールが可能な生物種は、マイコプラズマに限られ、大腸菌などの研究および産業で広く利用されているモデル生物での成功例はないのが現状です。課題の1つは、ゲノムサイズです。大腸菌ゲノムは460万塩基対とマイコプラズマゲノムよりも4倍以上大きく、その物理的長さは2ミリメートルと大腸菌の細胞サイズの1000倍近くになります。細胞内ではコンパクトに折り畳まれていますが、細胞の外に取り出すとすぐに切断され壊れてしまいます。
本研究では、大腸菌でのゲノムインストールを実現すべく、大腸菌ゲノムを複数個の小さな染色体として分割保持させることができないかを検討しました。大腸菌などのバクテリアでは、ゲノムは1つの大きな環状染色体にコードされていることが一般的ですが、そもそも真核生物では複数個の染色体に分割されてコードされています。マイコプラズマレベルまで小さく分割した染色体であれば、大腸菌の細胞への出し入れも可能となり、分割染色体のインストールによって、人工的な大腸菌を生み出すことも可能となるかもしれません。このような想定のもと、研究を進めました。
しかし、いまだゲノムのインストールが可能な生物種は、マイコプラズマに限られ、大腸菌などの研究および産業で広く利用されているモデル生物での成功例はないのが現状です。課題の1つは、ゲノムサイズです。大腸菌ゲノムは460万塩基対とマイコプラズマゲノムよりも4倍以上大きく、その物理的長さは2ミリメートルと大腸菌の細胞サイズの1000倍近くになります。細胞内ではコンパクトに折り畳まれていますが、細胞の外に取り出すとすぐに切断され壊れてしまいます。
本研究では、大腸菌でのゲノムインストールを実現すべく、大腸菌ゲノムを複数個の小さな染色体として分割保持させることができないかを検討しました。大腸菌などのバクテリアでは、ゲノムは1つの大きな環状染色体にコードされていることが一般的ですが、そもそも真核生物では複数個の染色体に分割されてコードされています。マイコプラズマレベルまで小さく分割した染色体であれば、大腸菌の細胞への出し入れも可能となり、分割染色体のインストールによって、人工的な大腸菌を生み出すことも可能となるかもしれません。このような想定のもと、研究を進めました。
研究の内容
大腸菌では、不要な遺伝子をできる限り削減し、ゲノムサイズを300万塩基対にまで小さくした最小ゲノム株が構築されています。大腸菌の細胞内で部位特異的な組み換え機構を利用することでゲノムの大きな領域を抜き出す手法を用いて、この最小ゲノムをさらに3つに分割し、1つ当たりのゲノムサイズを100万塩基対にまで小さくしました(図1)。3分割ゲノムを持つ大腸菌が生き残るには、抜き出された領域が分割染色体として細胞内で安定に複製、分配される必要があります。そこで、分割染色体の複製開始に必要な複製起点oriおよび分配システムparについて検討したところ、ビブリオ菌の第2染色体が持つori-parシステム注1)と大腸菌染色体自身の複製起点oriCと巨大プラスミド由来のsop分配システム注1)が分割染色体の安定性に有効であることを見いだしました。この方法で分割された染色体は、元のoriCを含むゲノム領域からなる染色体(図1中央 グレー)と、元の染色体から抜き出され、それぞれビブリオ菌由来のori-parシステム、あるいはoriC-sopシステムによって複製・分配が保証された染色体(図1中央 オレンジ、グリーン)の3分割状態で100世代を越えて安定に保持されました。大腸菌の増殖速度の低下も2分の1程度にとどまるものでした。
続いて、この3分割ゲノム大腸菌から、これら100万塩基対の分割染色体を取り出す方法を検討し、環状のスーパーコイルDNA注2)として分割染色体を精製することに成功しました。驚くべきことに、精製した分割染色体は電気パルスで細胞膜に孔を空けDNAを導入する古典的な手法であるエレクトロポレーション法により、460万塩基対の天然染色体を持つ別の大腸菌に導入することが可能でした(図1)。これは従来までの大腸菌に導入可能とされてきたDNAサイズを大きく上回るものです。また、3分割染色体を持つ大腸菌株間で分割染色体同士の入れ換えも可能であることを示しました。
続いて、この3分割ゲノム大腸菌から、これら100万塩基対の分割染色体を取り出す方法を検討し、環状のスーパーコイルDNA注2)として分割染色体を精製することに成功しました。驚くべきことに、精製した分割染色体は電気パルスで細胞膜に孔を空けDNAを導入する古典的な手法であるエレクトロポレーション法により、460万塩基対の天然染色体を持つ別の大腸菌に導入することが可能でした(図1)。これは従来までの大腸菌に導入可能とされてきたDNAサイズを大きく上回るものです。また、3分割染色体を持つ大腸菌株間で分割染色体同士の入れ換えも可能であることを示しました。
今後の展開
大腸菌ゲノムを3つに分割しても、大腸菌が安定増殖できたことは大変画期的で、3分割染色体の複製や分配がどのようにコントロールされているかを今後明らかにしていくことは重要です。
また本研究では、大腸菌で初めて100万塩基対のゲノムサイズDNAを細胞から取り出し、別の細胞にインストールすることに成功しました。本研究グループは、細胞の外(セルフリー)で大きなDNAを合成する技術の開発も進めており、100万塩基対の環状DNAをセルフリーで増幅する技術も報告しています。今後は、セルフリー合成された分割染色体を大腸菌にインストールすることで、物質生産など、有用な機能がデザインされた人工大腸菌の創成につながっていくものと期待されます。
また本研究では、大腸菌で初めて100万塩基対のゲノムサイズDNAを細胞から取り出し、別の細胞にインストールすることに成功しました。本研究グループは、細胞の外(セルフリー)で大きなDNAを合成する技術の開発も進めており、100万塩基対の環状DNAをセルフリーで増幅する技術も報告しています。今後は、セルフリー合成された分割染色体を大腸菌にインストールすることで、物質生産など、有用な機能がデザインされた人工大腸菌の創成につながっていくものと期待されます。
参考図
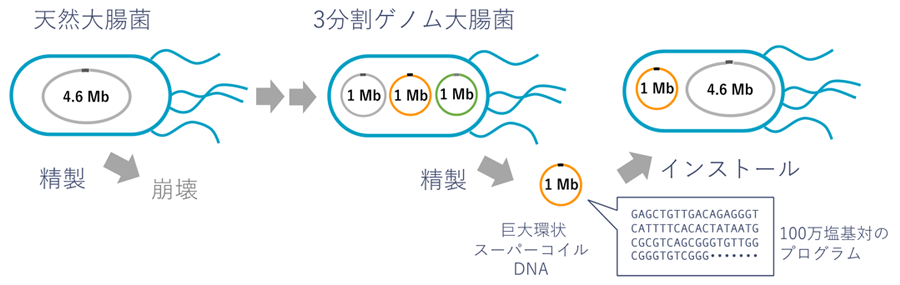
図1 3分割ゲノム大腸菌の作成と分割ゲノムのインストール
天然大腸菌のゲノムサイズは4.6メガベース(460万塩基対)と大きく、細胞の外に取り出して扱うことが難しい。そこでゲノムを3分割し、1つ当たりのサイズを1メガベース(100万塩基対)まで小さくした。この分断ゲノムは大腸菌の外に取り出して、別の大腸菌にインストールすることができる。
用語解説
注1)ori-parシステム、sop分配システム
ori-parシステムは、複製開始配列をコードするDNA領域oriと複製後DNAの分配に機能するDNA領域parからなるシステムで、細胞分裂して増殖するバクテリアに安定に大きなDNAを保持させるための機能を持つ。sop分配システムは、大腸菌Fプラスミド由来のparシステム。
注2)環状スーパーコイルDNA
よじれてコンパクトになっている状態の環状二重鎖DNA(閉環状DNA)。
ori-parシステムは、複製開始配列をコードするDNA領域oriと複製後DNAの分配に機能するDNA領域parからなるシステムで、細胞分裂して増殖するバクテリアに安定に大きなDNAを保持させるための機能を持つ。sop分配システムは、大腸菌Fプラスミド由来のparシステム。
注2)環状スーパーコイルDNA
よじれてコンパクトになっている状態の環状二重鎖DNA(閉環状DNA)。
論文タイトル
“Grand scale genome manipulation via chromosome swapping in Escherichia coli programmed by three one megabase chromosomes”
(3種の100万塩基染色体からなる大腸菌を用いた染色体交換による大規模ゲノム操作)
(3種の100万塩基染色体からなる大腸菌を用いた染色体交換による大規模ゲノム操作)
研究活動についての最新記事
-
2026/03/09 (MON)