OBJECTIVE.
千葉大学大学院理学研究院 荒井孝義教授(ソフト分子活性化研究センター長、千葉ヨウ素資源イノベーションセンター長)、立教大学理学部 山中正浩教授らの研究グループは、独自の触媒反応制御技術と化学反応の理論計算研究を組み合わせることにより、単純なアルケン基質とカルボン酸から、触媒的不斉ヨードエステル体を合成することに世界で初めて成功しました(図1)。これにより安価で入手容易な素材から高機能な化合物の生成が可能となります。さらにはこの化学合成手法を医薬品に応用することで、医薬品の多機能化にも貢献すると期待されます。
本研究成果は、独化学誌「Angewandte Chemie International Edition」に掲載されました。
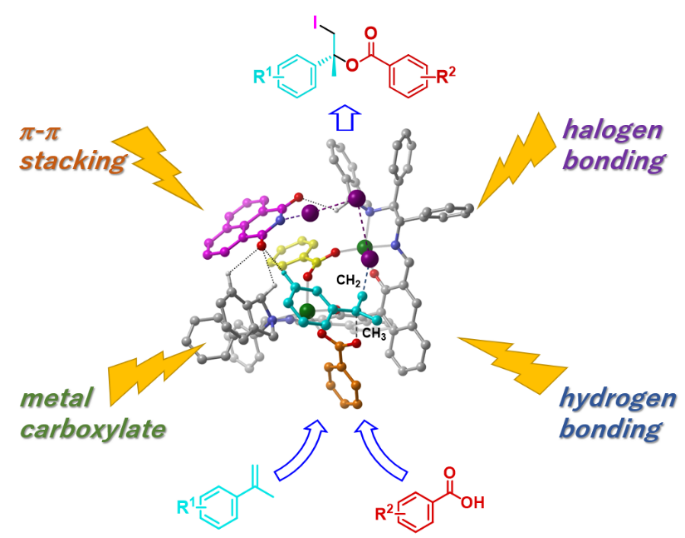
図1:開発した触媒的不斉ヨードエステル化の概念図。金属カルボン酸塩の形成、ハロゲン結合、水素結合にπ‐πスタッキング4種の化学結合を1つの触媒上に協調させることにより、合成反応に世界で初めて成功した。
研究の背景と目的
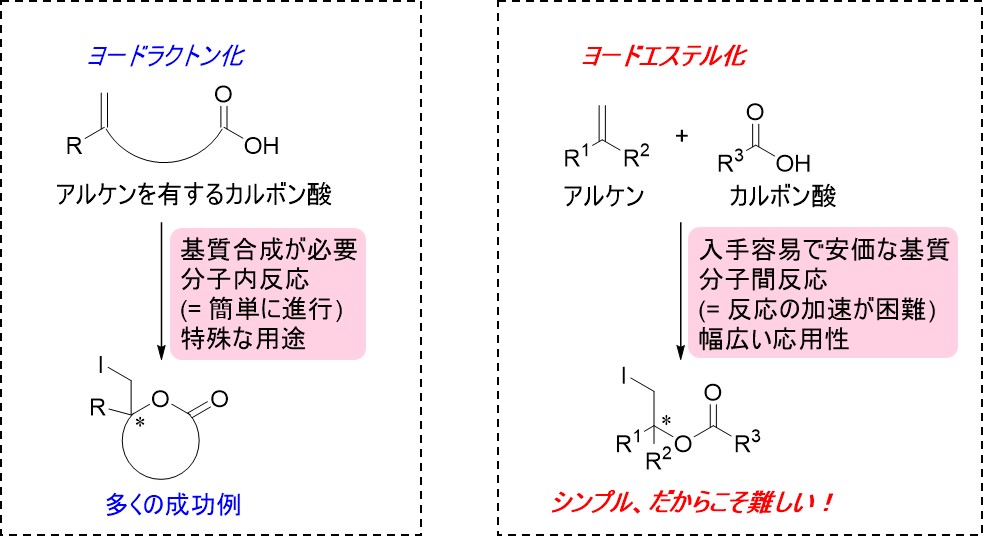
図2:ヨードラクトン化とヨードエステル化。いずれもヨウ素を使用したハロエステル化であるが、ヨードエステル化は、アルケンとカルボン酸の異なる分子間での反応を促進する必要があり、その為の高度な立体構造認識とその制御が極めて難しく、成功例がなかった。
カルボン酸とアルコールから得られるエステル化合物は、化成品や医薬品の製造など、工業的に広く用いられる重要な化合物です。中でも、ヨウ素を用いたエステル化合物の合成反応のひとつである「触媒的不斉ヨードエステル化」は、広く活用されているヨードラクトン化に比べ安価で市販されている素材で実施できることから、産業プロセスを簡略化するといった非常に高い工業的価値をもつことが明らかでした。しかし、触媒的不斉ヨードエステル化を実現するためには、分子内反応によるヨードラクトン化とは異なり、異なる分子間での反応を進行させるために立体選択性といった高度な分子構造認識とその緻密な制御が不可欠であった為、これまで誰も実現できていませんでした。(図2)
研究成果
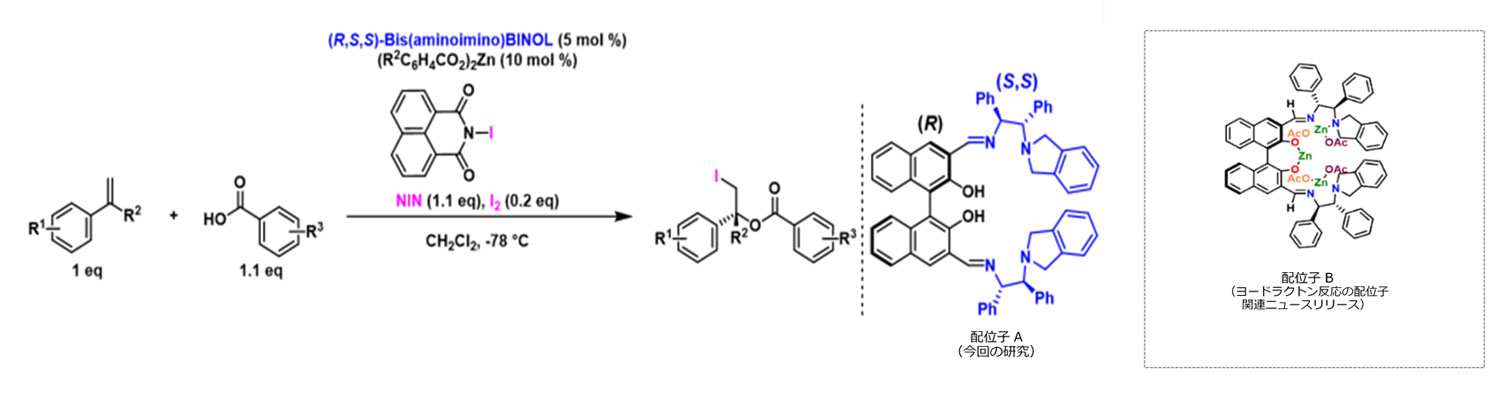
図3:本研究で成功した世界初の触媒的不斉ヨードエステル化反応とその配位子と、これまでに明らかにしていた不斉ヨードラクトン触媒の構造式。配位子A、Bは構造異性体の関係。
その結果、ヨードラクトン化反応とは異なる立体構造を有する配位子A(立体異性体)を開発し、ヨードエステル体を得るための最適条件を特定することに成功しました。そして新たな反応を用いることにより、高い化学収率と鏡像異性体過剰率注1)をもって目的のヨードエステル体を得ることができました(図3)。
さらに、この触媒的不斉ヨードエステル体の形成メカニズムを詳細に分析したところ、図1に示すように、金属カルボン酸塩の形成、ハロゲン結合注2)、水素結合にπ‐πスタッキング注3)、計4種の異なる力を1つの触媒上で協調させることによって、反応が成功したことが明らかになりました。4種の力の中では、金属カルボン酸塩の形成力が最も強く支配的で、残りの3種の力を如何に適切な位置に配置して協奏させるかが課題となりました。研究では、π‐πスタッキングの力を強めるために平面性の高いナフタレン骨格を有するヨウ素化剤を新規に開発して反応に用いることで、高い鏡像異性体過剰率を達成しています。
【関連ニュースリリース】
社会貢献性・波及効果
研究者のコメント(千葉大学ソフト分子活性化研究センター長、千葉ヨウ素資源イノベーションセンター長 荒井 孝義)
論文情報
雑誌名:Angewandte Chemie International Edition
DOI:https://doi.org/10.1002/anie.202003886
研究プロジェクトについて
- 科学研究費補助金 基盤研究(B) JP19H02709
- 科学研究費補助金(JP16H01004、JP18H04237、JP17KT0011)
用語説明
1)鏡像異性体過剰率(enantiomeric excess:ee)
キラル化合物について、一方の鏡像異性体をR、もう一方の異性体をSと表し、それぞれの分子量を[R][S]とすると、その化合物の鏡像体過剰率は次式で定義される。
2)ハロゲン結合:
ヨウ素などのハロゲン原子(ルイス酸)とルイス塩基との間に働く非共有結合性の静電的相互作用のこと。明確な方向性をもつ新たな相互作用として触媒化学や機能性分子創製への応用が期待されている。
3)π‐πスタッキング:
有機化合物分子の芳香環の間に働く分散力である。2つの芳香環がコインを積み重ねたような配置で安定化する。